Prvky skupiny IV.A
C, Si, Ge, Sn, Pb: uhlík, křemík, germanium, cín, olovoCésar si Germány snadno podrobil
14. skupina (IV.A)
elektronová konfigurace valenční vrstvy: ns2 np2 – 4 valenční elektrony
pevné látky
Uhlík
chemie uhlíku – organická a anorganická (C, CO2, CO, H2CO3 a její soli, sirouhlík, karbidy, kyanidy)budeme probírat anorganickou chemii
Výskyt
-
volný – diamant, grafit
-
vázaný – CO2
uhličitany: vápenec – CaCO3, dolomit – CaMg(CO3)2, magnezit – MgCO3
je součástí živé hmoty
Modifikace uhlíku
grafit (tuha)diamant
fullereny
Grafit
(z řeckého grafein – psát)Struktura
normálně má uhlík elektronovou konfiguraci C: [He] 2s2 2p2, v přírodě se ale vyskytuje i ve svém excitovaném stavu: C*: [He] 2s1 2p3 – až 4-vaznývrstevnatá struktura
jedna vrstva – atom spojen se třemi sousedními atomy uhlíku, jeden elektron se může volně pohybovat; atomy uhlíku uspořádány do šestiúhelníků
mezi vrstvami působí Van der Waalsovy síly, jsou tam delokalizované elektrony

Vlastnosti
šedočerná barvavede elektrický proud (díky volným elektronům)
je měkký a otírá se
vysoká teplota tání
Užití
tuhy do tužekelektrody
mazadlo do ložisek (grafitový prášek)
výroba žáruvzdorného materiálu
jaderné reaktory (grafitové tyče zpomalují reakci)
Diamant
každý uhlík je spojen kovalentními vazbami se čtyřmi sousedními uhlíky (vrcholy čtyřstěnu)diamant nemá volný elektron, nevede elektřinu
láme světlo
nejtvrdší přírodní materiál – 10. stupeň Mohsovy stupnice tvrdosti
Užití
řezání sklavrtné hlavice
šperkařství
broušené diamanty – brilianty
u diamantů karáty udávají hmotnost (1 karát odpovídá 0,205g; u zlata udávají ryzost zlata
fasety – vybroušené plošky
umělé diamanty – vyráběné z grafitu za vysoké teploty a tlaku
Fullereny
umělá modifikacejsou tvořeny z jednotlivých molekul ve tvaru mnohostěnu (vypadají trochu jako fotbalový míč)
Technické formy uhlíku
Aktivní uhlí
(živočišné uhlí)pórovitá látka s velikým povrchem
má adsorpční účinky (zachycuje jiné látky na povrchu)
(neplést s absorbční – pohlcování)
filtry – akvárium, plynové masky, digestoř
ve farmacii
Saze
vznikají nedokonalým spalováním uhlíkatých látekvýroba pneumatik, výroba tiskařské černi
Koks
vzniká při karbonizaci uhlí – zahřívání uhlí bez přístupu vzduchupalivo
redukční činidlo při výrobě železa
Přirodní uhlí
liší se obsahem uhlíku- antracit – kolem 90% uhlíku
- černé uhlí – kolem 80% uhlíku
- hnědé uhlí – kolem 70% uhlíku
- lignit – kolem 60% uhlíku
-
rašelina – kolem 50% uhlíku
Anorganické sloučeniny uhlíku
- oxid uhličitý
- oxid uhelnatý
- kyselina uhličitá a její soli
-
sirouhlík, karbidy, kyanovodík, kyanidy, kyselina kyanatá
Oxid uhličitý
CO2bezbarvý plyn
těžší než vzduch (ca 1,5-krát)
není toxický, ale je nedýchatelný
není hořlavý
při ochlazování (ca -78,5ºC) dochází k desublimaci – plyn se mění v pevnou látku
kapalný CO2 se za normálního tlaku nevyskytuje
v atmosféře – ca 0,03obj%
je reaktant při fotosyntéze:
6CO2 + 6H2O → (chlorofyl, svtlo) C6H12O6 + 6O2
pokud množství CO2 v prostředí přesáhne 10%, dochází u lidí k udušení – kvasné sklepy, studně, jeskyně, silo
Struktura molekuly
uprostřed uhlík, z obou stran dvojnou vazbou připojen kyslík, v každé dvojné vazbě je jedna vazba sigma (σ), druhá pí (π)jednotlivé vazby jsou sice polární – elektrony jsou blíže ke kyslíku, navzájem se ale síly vyruší, molekula je nepolární
má lineární tvar (atomy jsou na jedné přímce)
Vznik
-
při dokonalém spalování (za dostatku kyslíku) uhlíkatých látek: C + O2 → CO2
-
dýchání
-
při kvašení (fermentaci)
-
sopečné plyny
Laboratorní příprava
na uhličitan vápenatý (CaCO3) nalijeme kyselinu chlorovodíkovou (HCl):CaCO3 + 2HCl → [H2CO3 + CaCl2] → CO2 + H2O + CaCl2
H2CO3 je nestálá a rozkládá se na CO2 + H2O
tato reakce se často provádí v Kippově přístroji
Výroba
pálení vápence:CaCO3 → (t) CaO + CO2
Užití
-
sycení nápojů – zavádění pod tlakem
-
hasicí přístroje – sněhové, díky nehořlavosti CO2
-
„suchý led” – k chlazení
Důkaz
zakalení vápenné vody – přefiltrovaný roztok hydroxidu vápenatého (Ca(OH)2)Ca(OH)2 + CO2 → CaCO3 ↓ +H2O
CaCO3 je ve vodě nerozpustný, způsobí zákal
Oxid uhelnatý
CObezbarvý plyn
toxický – váže se na krevní barvivo hemoglobin, na něj se pak nemůže navázat kyslík, dochází k udušení
ve výfukových plynech
hořlavý
součást některých topných plynů (např. svíiplyn), ty jsou často nahrazeny
ve vodě je nerozpustný
redukční činidlo ⇒ výroba železa
Vznik
při nedokonalém spalování uhlíkatých láteknejdříve vzniká CO2, to se díky dalšímu uhlíku změní na CO:
C + O2 → CO2
CO2 + C → 2CO
Výsledná rovnice je 2C + O2 → 2CO
Laboratorní příprava
dehydratace kyseliny mravenčí (HCOOH):HCOOH → (H2SO4) CO + H2O
Poznámka
CO může existovat jako ligand v komplexních sloučeninách pod názvem karbonylKyselina uhličitá
H2CO3bezbarvá kapalina
nestálá, rozkládá se na CO2 + H2O
vzniká zaváděním oxidu uhličitého do vody:
CO2 + H2O → H2CO3
při zavádění CO2 do vody část probublá, část se rozpustí a pouze malá část zreaguje
Výskyt
kyselky (z CO2 vulkanického původu), minerálkydešťová voda – kyselá díky CO2 ve vzduchu
H2CO3 v dešťové vodě způsobuje a podílí se na rozrušování vápence, korozi, měděnce
Soli kyseliny uhličité
uhličitany (obsahují uhličitanový anion CO32 − ), hydrogenuhličitany (hydrogenuhličitanový anion HCO3 − )Příprava
☉hydroxidu +CO2
Ca(OH)2 + CO2 → CaCO3 + H2O
CaCO3 + H2O + CO2 → Ca(HCO3)2
2NaOH + CO2 → Na2CO3 + H2O
Na2CO3 + H2O + CO2 → 2NaHCO3
Na2CO3 + H2O + CO2 → 2NaHCO3
Vlastnosti
většinou jsou ve vodě nerozpustné, výjimkou jsou uhličitany alkalických kovůpři reakci s kyselinou vzniká oxid uhličitý:
CaCO3 + HCl → H2CO3 + CaCl2 → CO2 + H2O + CaCl2
(H2CO3 je nestálá a rozpadá se na CO2 + H2O)
tato reakce slouží pro zjištění, zda je kámen vápenec
odstranění vodního kamene
NaHCO3 + HCl → CO2 + H2O + NaCl
proti pálení žáhy – NaHCO3 je roztok jedlé sody, HCl se při pálení žáhy dostává do jícnu
Uhličitan sodný
Na2CO3soda (̸= krystalická soda, ̸= jedlá soda)
výroba skla, pracích prášků a mýdla
Hydrogenuhličitan sodný
NaHCO3jedlá soda, užívací soda, soda bikarbona
proti pálení žáhy – neutralizace HCl, viz výše
jako prášek do pečení:
2NaHCO3 → (t) Na2CO3 + CO2 + H2O; CO2 je kypřící plyn
do práškových hasících přístrojů – viz rovnice o řádek výše – za tepla se mění mimo jiné na CO2
Uhličitan vápenatý
CacO3vápenec
používá se jako stavební materiál
Uhličitan draselný
K2CO3podobné užití jako soda – výroba skla, pracích prostředků, mýdla
Koloběh vápence v přírodě
vápenec v jeskyni reaguje s vodou a CO2:CaCO3 + H2O + CO2 → Ca(HCO3)2
Ca(HCO3)2) se ve vodě rozpouští
krápníky vznikají tak, že se Ca(HCO3)2 zase mění na nerozpustný vápenec (CaCO3)
rovnováhou mezi těmito reakcemi postupně krápníky rostou – „roztají”, „ztuhnou”, . . . tím, jak se neustále CaCO3 mění na Ca(HCO3)2 a zpátky
Koloběh vápence v průmyslu
pálení vápence:CaCO3 → (t) CaO + CO2
CaO – pálené vápno
CaO + H2O → Ca(OH)2
exotermická reakce
Ca(OH)2 – hašené vápno
Ca(OH)2 + H2O+ písek → vápenná malta
rovnice tvrdnutí vápenné malty:
Ca(OH)2 + CO2 → CaCO3 + H2O
CaCO3 – tvrdá látka, nerozpustná ve vodě
Další anorganické sloučeniny uhlíku
Karbidy
karbidy – dvouprvkové sloučeniny uhlíku a prvku s nízkou elektronegativitouKarbid vápenatý
(acetilid vápenatý)CaC2
výroba acetylenu:
CaC2 + 2H2O → C2H2 + Ca(OH)2
C2H2 – acetylen
Karbid křemíku
SiC (karborundum)tvrdá látka, používá se k řezání
Sirouhlík
CS2kapalina
toxický, hořlavý
výborné nepolární rozpouštědlo (bílý fosfor, tuky, síra)
Kyanovodík
HCNkapalina
voní po hořkých mandlích
prudce toxický
teplota varu kolem 25 ºC
dobře rozpustný ve vodě, vzniká kyanovodíková kyselina
soli – kyanidy
kyanidy obsahují anion CN −
Kyanid draselný
KCNcyankáli
0,3 – 0,4g smrtelné
prudký jed
Křemík
výskyt: volný (v přírodě se nevyskytuje), vázaný (kyslíkaté sloučeniny – křemen, křemičitany, hlinitokřemičitany); 2. nejrozšířenější prvek v zemské kůřeVlastnosti
pevná šedá a lesklá látkatvrdý – strukturou podobný diamantu
polovodič
oxidační číslo: nejčastěji IV
na povrchu se tvoří SiO2 – odolný vůči působení kyslíku a vody, tomuto procesu se říká pasivace
odolný vůči kyselinám (kromě HF)
při reakci s hydroxidy vznikají křemičitany
málo reaktivní
Výroba
redukce křemenu (SiO2) čistým koksem v elektrické peciSiO2 + C → Si + CO
Užití
elektrotechnika (integrované obvody)silikonové polymery
různé slitiny
Oxid křemičitý
SiO2alotropické modifikace (vzestupně dle teploty, při které se vyskytují) – křemen, tridymit, cristobalit
barevné odrůdy křemene: ametist (fialová), citrín (žlutá), růženín (růžová), záhněda (hnědá)
struktura křemene: základní stavební jednotkou je SiO4 (kyslíky jsou rozmístěny do vrcholu čtyřstěnu – tetraedru), tetraedry spojeny přes kyslík
vlastnosti: tvrdá látka, vysoká teplota tání, chemicky odolný
pouze čistému křemeni se říká křišťál
Kyseliny křemičité
kyselina orthokřemičitá (tetrahydrogenkřemičitá) – H4SiO4kyselina methakřemičitá (H2SiO3)
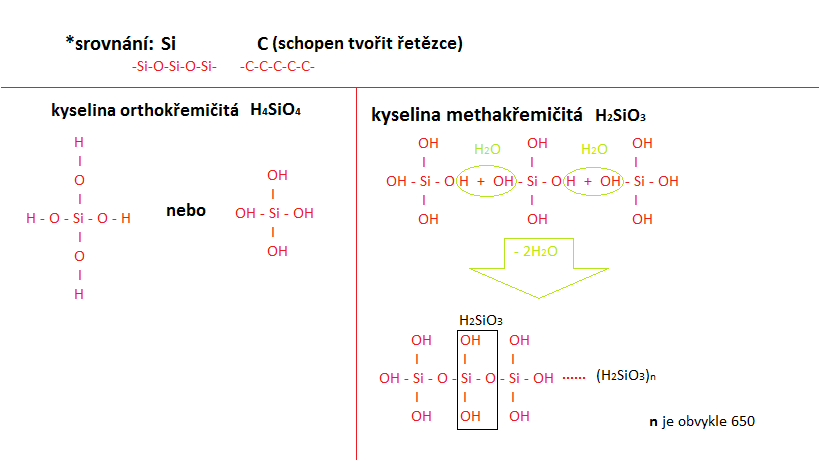
(obrázek – Terka Sl.)
od těchto kyselin se dají odvozovat soli – křemičitany
Křemičitany
Vodní sklo
roztok křemičitanu sodného a draselnéhopoužívá se k impregnaci papíru a tkanin, lepení skla a porcelánu, ke konzervaci vajec
Silikagel
má velký povrchmá adsorpční schopnosti
Výroba skla
Křemenné sklo
SiO2 (křemenný písek) → (t) tavenina → (ochlazení) sklopři ochlazování nedochází ke krystalizaci
křemenný písek a sklo se liší strukturou: zatímco křemený písek tvoří pravidelné krystaly, sklo má sice pořád tetraedrické uspořádání (molekuly do čtyřstěnu), ale už ne pravidelné ⇒ sklo je amorfní látka
Suroviny
křemenný píseksoda (Na2CO3)
vápenec (CaCO3)
Technický postup
-
důkladné promíchání surovin, vzniká tzv. sklářský kmen
-
tavení (ca 1500ºC)
-
čeření – odstranění bublinek plynu
-
ochlazení na pracovní teplotu – kolem 900ºC
-
zpracování – válcováním, foukáním, tažením, litím
-
pomalé ochlazování
Vlastnosti skla
lze ovlivnit různými přidanými látkami-
místo Na2CO3 použijeme K2CO3 – získáme tepelně odolné sklo
-
místo CaCO3 použijeme sloučeninu olova – získáme sklo s vysokým indexem lomu
-
barvy:
modré sklo – přidání CoO
zelené sklo – přidání FeO
hnědé sklo – přidání Fe2O3
-
nepohlcuje pachy a výborně čistí
-
odolné vůči většině látek – výjimkou je např. fluor, kyselina fluorovodíková
Cín
značka Snvýskyt: volný (v přírodě se nevyskytuje), vázaný (nejběžnější rudou je cínovec (kasiterit, SnO2))
modifikace: šedý (do 13ºC), bílý (do 161ºC), křehký
Bílý cín
měkká, stříbrolesklá látkaje tažný a kujný (staniol)
na vzduchu je odolný, protože se pasivuje (pokrývá se) vrstvou SnO2
nereaguje ani s kyselinami, ani s hydroxidy
Šedý cín
šedý prášek„cínový mor” – přeměna bílého cínu na šedý ochlazením (v muzeu se jim ničilo cínové nádobí)
Užití cínu
ochrana méně odolných kovůbílý plech – potravinářství
bronz – Cu + Sn
pájky – Sn + Pb
liteřina – Sn + Pb + Sb – tiskařství
Olovo
výskyt – volný (téměř se nevyskytuje), vázaný (nejdůležitější ruda – galenit – PbS)Výroba
-
převedení sulfidu na oxid pražením:
2PbS + 3O2 → 2PbO + 2SO2
-
redukce uhlíkem:
PbO + C → Pb + CO
Vlastnosti
měkký šedý kovkujný
je reaktivnější než cín
Užití
do slitinochranné štíty proti zářením
akumulátory
Sloučeniny
Oxid olovičitý
PbO2používá se k výrobě akumulátorů
Chroman olovnatý
PbCrO4chromová žluť, používá se jako žluté barvivo
Oxid olovnato-olovičitý
suřík, miniumlátka se ve skutečnosti jmenuje jinak, proto neodpovídá její vzorec:
Pb3O4
používá se k výrobě antikorozních nátěrů
Jedovatost olova
samotné olovo není nebezpečné, nebezpečné jsou jeho páry a ve vodě rozpustné sloučeninyolovo se vstřebává nejen plicemi, ale i přes kůži
pak se hromadí v organismu
Olověný akumulátor
používají se nejen v autech, ale i jako záložní zdrojesekundární galvanický článek – lze ho vybít, ale i nabít
obsahuje střídavě desky Pb a PbO2, celé je to ponořené v H2SO4
vybíjení: Pb + PbO2 + 2H2SO4 → 2PbSO4 + 2H2O
Pb0 − 2e − → PbII oxidace
PbIV + 2e − → PbII redukce
elektrony tedy putují od jedné elektrody k druhé – od elektrody s Pb do elektrody s PbO2
nabíjení: probíhá elektrolýza:
2PbSO4 + 2H2O → Pb + PbO2 + 2H2SO4