Stavba atomu
V 5. stol. před naším letopočtem Demokritos vyslovil, že je nějaká částice, která už nejde dále rozdělit – atomos (nedělitelný)V roce 1808 Dalton vyslovil atomovou teorii – Vše se skládá z atomů
Velikost atomu – 10-10m = ca 100pm = 1Å = 1 angström
Ca v roce 1900 J.J.Thompson zjistil, že atomy se skládají z ještě menších částic (elektronů a protonů)
Modely atomu
- Thomsonův model atomu (pozor: nikoli Thompson!) – atom byla údajně kladně nabitá hmota, ve které byly rozesety záporně nabité elektrony – pudingový model
- Rutherfordův model atomu (planetární model) – Rutherford tvrdil, že ve středu je jádro, které je kladně nabité, kolem něj obíhají v elektronovém obalu elektrony (podobně jako planety okolo Slunce)
Problém s touto teorií byl ten, že elektrony by se po nějakém čase zřítily do jádra - Bohrův model atomu – elektrony se pohybují v nějakých vrstvách (po kružnicích se stálým poloměrem) – elektron ve vrstvě má určitou energii – na to, aby elektron přeskočil do jiné vrstvy, musí přijmout nebo vydat energii (při přechodu na vyšší vrstvu musí energii přijmout, při přechodu na nižší vrstvu uvolnit)
Problém s tímto modelem je, že elektron má duální charaker – chová se jednak jako normální částice s nějakou hmotností, ale zároveň se chová jako vlnění (což je např. světlo)
Kvůli tomu pro elektrony nefunguje klasická mechanika – musíme použít kvantovou mechaniku - Kvantově mechanický model atomu – dodnes platný
Kvantově mechanický model atomu
Atomové jádro
Průměr: 10-14m (tj. řádově 10 000-krát menší než atom)Je kladně nabité, je hmotné
- protony – p+ – kladně nabité; hmotnost: 1,66×10-27kg; což odpovídá atomové hmotnostní konstantě
Počet protonů v jádře udává protonové číslo (Z) - neutrony – n0 – taktéž hmotnost: 1,66×10-27kg
počet neutronů udává neutronové číslo (N)
počet neutronů+protonů – nukleonové číslo (A)
Elektronový obal
elektron – e-Hmotnost elektronu je 9,1 × 10-31kg, relativní hmotnost je 11840
náboj elektronů je -1,6 × 10-19 c (coulombů)
elektron má duální charakter – je zároveň částice i vlnění – nedá se příliš představit
Heisenbergův princip neurčitosti – říká, že nemůžeme zároveň určit polohu a hybnost částice
My ale můžeme určit pravděpodobnost výskytu elektronu – orbital – prostor kolem jádra, kde se elektron vyskytuje s vysokou (95%) pravděpodobností – s rostoucí vzdáleností od jádra klesá pravděpodobnost výskytu

Kvantová čísla
Každý elektron má svojí "adresu" – každý elektron je popsán 4 kvantovými čísly (v jednom atomu neexistují dva atomy, které by měly shodnou kombinaci těchto 4 čísel)Kvantová čísla vlastně popisují atomový orbital a elektrony v něm
Hlavní kvantové číslo
značí se n, nabývá hodnot od 1 do nekonečna (1, 2, 3, ...)
V reálu však nabývá hodnot 1 až 7
Hlavní kvantové číslo označuje velikost a energii orbitalu
Vedlejší kvantové číslo
značí se l, nabývá hodnot od 0 do n-1
Udává energii a prostorový tvar orbitalu
Místo čísla se často značí písmeny – písmenné označení orbitalu se liší podle hodnoty l:
hodnota l 0 1 2 3 označení s p d f
- s – vypadá jako koule
- p – vypadá jako 3d osmička ze dvou koulí
- d – čtyřlistá květina nebo oboustranný dudlík
Magnetické číslo
značí se m, nabývá hodnot od -l do l
charakterizuje prostorovou orientaci orbitalu
označení orbitalu: hodnota n + hodnota l z tabulky (tj. pro n=1 a l=0 je to 1s)
Počet hodnot m udává počet orbitalů daného typu ( Pro:- n=1:
- l=0 (orbital 1s); m=0; 2 elektrony (jeden s m=0 a s=1/2, druhý s m=0 a s=-1/2)
- n=2:
- l=0 (orbital 2s); m=0; 2 elektrony
- l=1 (orbital 2p); m=-1, 0, 1; 6 elektronů (obecně je to počet možných m × počet možných s, což je počet kombinací m × 2 (protože s může být vždy buď 1/2 nebo -1/2) – v tomto případě 3×2 = 6)
- n=3:
- l=0 (orbital 3s); m=0; 2 elektrony
- l=1 (orbital 3p); m=-1, 0, 1; 6 elektronů
- l=2 (orbital 3d); m=-2, -1, 0, 1, 2; 10 elektronů
- n=4:
- l=0 (orbital 4s); m=0; 2 elektrony
- l=1 (orbital 4p); m=-1, 0, 1; 6 elektronů
- l=2 (orbital 4d); m=-2, -1, 0, 1, 2; 10 elektronů
- l=3 (orbital 4f); m=-3, -2, -1, 0, 1, 2, 3; 14 elektronů
Prostorové tvary orbitalů
Počet možností, jak může daný orbital vypadat, nám určuje m
- s: počet možností m je 1, a to m=0
orbital s je koule, tudíž má jen jednu možnou prostorovou orientaci - p: počet možností m je 3, a to m=-1,0,1
orbital p je osmička ze dvou koulí, může být na třech osách (x,y,z; podle toho se orbitaly jmenují px, py, pz) - d: počet možností m je 5, a to m=-2,-1,0,1,2
orbital d je jakýsi čtyřlístek; obrázky jsou v učebnici
Degenerované orbitaly
Několik orbitalů, které mají stejné hlavní a vedlejší kvantové číslo – mají stejné n a l → mají stejnou energii (tj. pokud by existovaly dva orbitaly – např. orbital, pro který platí n=3, l=2 a m=-2 a orbital, pro který platí n=3, l=2, m=-1, jsou tyto orbitaly degenerované)- n=1:
Spinové číslo
značí se s, nabývá hodnot -1/2 a +1/2.
spinové číslo udává orientaci elektronů (můžeme si zjednodušeně představit, že elektron se spinovým číslem 1/2 se točí na jednu stranu a elektron se spinovým číslem -1/2 se točí na druhou stranu)
Pro stejné n, l a m můžou existovat maximálně dva elektrony – jeden se spinovým číslem 1/2, druhý se spinovým číslem -1/2.
Kolik elektronů může být v daném orbitalu, pokud víme, že:
- n=4, l=2, m=-1: Jedná se o orbital 4d; jelikož může m nabývat jen jedné hodnoty, počet elektronů je 1×2 = 2
- n=3, l=0: Jedná se o orbital 3s; protože l=0, m může nabývat jen jedné hodnoty, tudíž počet elektronů je 1×2 = 2
- n=5, l=2, m=3: Takový orbital neexistuje, protože m>l, což nejde
- n=2, l=1, m=0: Orbital 2p, zase jsou tam pouze 2×1 = 2 elektrony
- n=2, l=3, m=0: l>n, což nejde, takže takový orbital neexistuje
Které orbitaly existují?
Podle čísla a písmena najdeme hodnotu n a l, orbital existuje pouze, pokud n>l
1s: ano (n=1; l=0)
2s: ano
3f: ne (n=3; l=3)
2d: ne (n=2; l=2)
6s: ano (n=6; l=0)
1p: ne (n=1; l=1)
4s: ano (n=4; l=0)
4p: ano
3d: ano
1f: ne
Kolik elektronů mají tyto orbitaly?
(rada pro vychytralé – pokud máme určené jen n (nebo n a l), počet možných hodnot m je 2l+1 (od 1 do l, od -1 do l; a nula), tudíž počet možných elektronů je 4l+2)
(rada pro vychytralé – pokud máme určené jen n (nebo n a l), počet možných hodnot m je 2l+1 (od 1 do l, od -1 do l; a nula), tudíž počet možných elektronů je 4l+2)
- 4f: n=4, l=3, m=-3,-2,-1,0,1,2,3 (tj. m může nabývat 7 hodnot); s může pro každé m nabývat 2 hodnoty, tj maximálně může být 7×2 = 14 elektronů
- 5d: n=5, l=2: maximálně může být 4l+2 = 6+2 = 10 elektronů
- 3p: n=3, l=1: může být 4l+2 = 4+2 = 6 elektronů
- 2p: n=2, l=1: opět 6 elektronů
- 6f: n=6, l=3: opět 14 elektronů
Kolik elektronů má:
- n=2: l může být buď 0 nebo 1
pro l=0 můžou být 2 elektrony (4l+2 = 0+2 = 2)
pro l=1 může být 6 elektronů (4l+2 = 4+2 = 6)
Dohromady tedy 2+6 = 8 elektronů - n=4: l=0,1,2,3
pro l=0 můžou být 2 elektrony
l=1: 6 elektronů
l=2: 10 elektronů
l=3: 14 elektronů
Dohromady tedy 2+6+10+14 = 32 elektronů
Znázorňování orbitalů a elektronů
Elektrony
Elektrony se značí šipkami – ↑ (spinové číslo 1/2) a ↓ (spinové číslo -1/2)Orbitaly
používají se rámečkové diagramyOrbital má tolik rámečků, kolik je možných hodnot magnetického čísla, v každém rámečku může mít maximálně jednu šipku nahoru a jednu dolů
1s
| ↑ |
1s
| ↑↓ |
2s
| ↑↓ | ↑↓ | ↑↓ |
3d
| ↑ | ↑ |
Další způsob značení je horní index, který značí počet elektronů – pro předchozí příklady jsou to orbitaly 1s1, 1s2, 2p6, 3d2
Energie orbitalů
Energie orbitalů se určuje součtem n+l – orbital s větším součtem má i větší energii, pokud máme více orbitalů se stejným součtem, rozhodujeme se podle hlavního kvantového čísla. (tj. 4d i 6s mají oba stejné n+l: 4+2 = 6+0 = 6; větší energii má orbital 6s)
Který z orbitalů má největší energii?
- 4f: n=4; l=3; n+l=7
- 4d: n=4; l=2; n+l=6
- 6s: n=6; l=0; n+l=6
- 5s: n=5; l=0; n+l=5
- 5p: n=5; l=1; n+l=6
Pravidla pro zaplňování orbitalů
Pauliho princip výlučnosti
V orbitalu mohou být pouze dva elektrony tvořící elektronový pár a lišící se spinovým číslem.
(nemůže existovat orbital 1s
)↑↑ Výstavbový princip
Orbitaly o nižší energii se zaplňují dříve
máme orbitaly 3s, 3p, 3d, 4s, 4p – pokud je seřadíme podle energie od nejmenšího, dostaneme: 3s, 3p, 4s, 3d, 4p. To je také pořadí, ve kterém se budou orbitaly postupně zaplňovat.Vypište prvních deset orbitalů s nejmenší energií
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p
Hundovo pravidlo
"autobusové pravidlo"
orbitaly o stejné energii (degenerované orbitaly) se zaplní nejdříve jedním elektronem, teprve pak se tvoří elektronové páry; nespárované elektrony musí mít stejný spin.
Autobusové pravidlo se mu říká proto, že i v autobuse si nejdřív lidé sedají na úplně volná dvojmísta (i když si klidně můžou sednout i vedle někoho), teprve pak si sedají vedle někoho.
Elektronové konfigurace prvků
je to zápis popisující umístění elektronů v elektronovém obaluJe nutno dodržovat pravidla (Pauliho princip výlučnosti, výstavbový princip a Hundovo pravido)
U atomu platí, že počet protonů je stejný jako počet elektronů
Pokud chceme určit elektronovou konfiguraci nějakého prvku, musíme se dívat do tabulky: Prvky ve skupinách máme rozděleny na s-prvky, p-prvky, d-prvky a f-prvky.
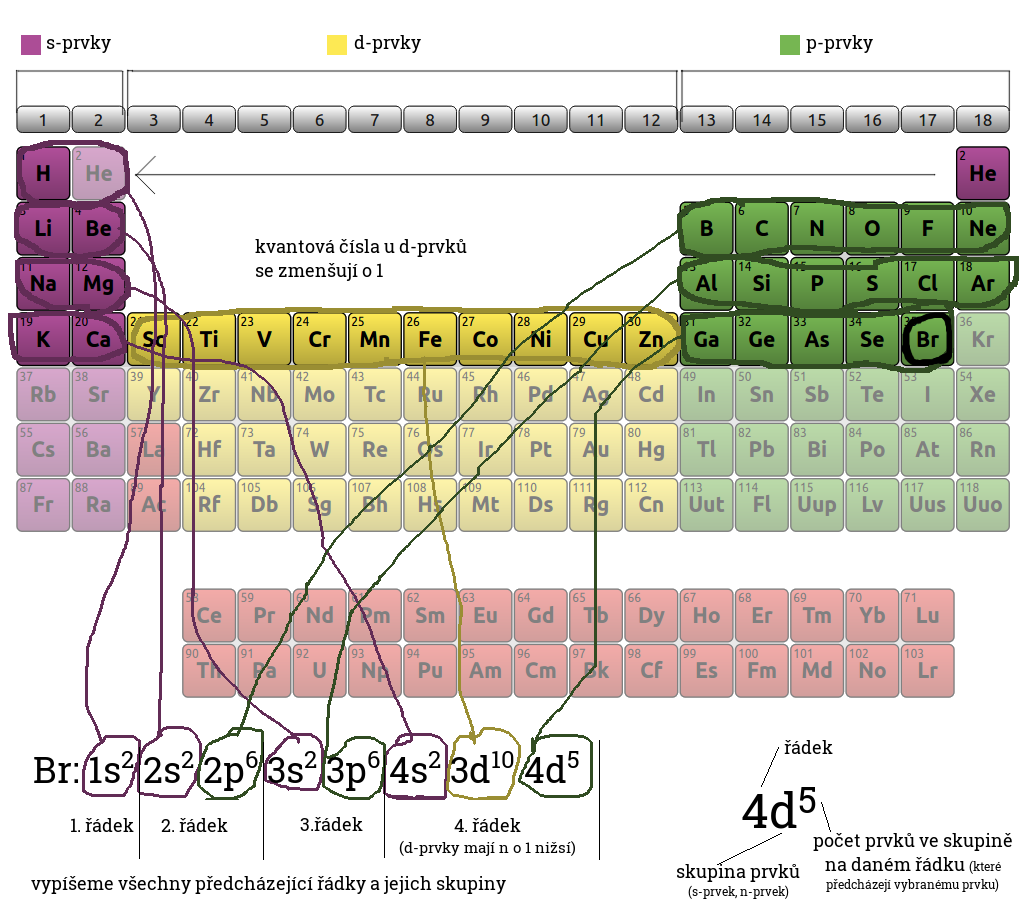
Pozor, u d-prvků musíme snižovat o 1
H: 1s
| ↑ |
He: 1s
| ↑↓ |
Li: 1s
| ↑↓ |
| ↑ |
Be: 1s
| ↑↓ |
| ↑↓ |
B: 1s2 2s2 2p1 (pamatujme, že orbitaly o nižší energii se zaplňují dříve)
Všichni se přihlásí na moodle do skupiny "Chemie 5.A", heslo je CH5A
Elektronová konfigurace iontů
Je podobná elektronové konfiguraci prvkůH- (hydridový anion(t)): 1s2 (stejně jako helium) – iont má pořád stejně protonů jako prvkek, ale má více elektronů – hledáme konfiguraci pro 2 elektrony
O2- (oxidový anion): 1s2 2s2 2p6 – iont nemá 8 elektronů (jako by měl normální kyslík), ale 8+2=10 elektronů – hledáme konfiguraci pro 10 elektronů (posuneme se o 2 místa doprava)
Na+: 1s2 2s2 2p6 – tento kation má o 1 méně elektronů, než normální sodík, tudíž 11-1=10 elektronů – má stejnou elektronovou konfiguraci jako prvek s 10 elektrony (což je neon)
Elektronová konfigurace pomocí vzácných plynů
(zkrácená konfigurace)Najdeme si nejbližší předchozí vzácný plyn, ten napíšeme do hranatých závorek, za něj napíšeme pouze elektronové konfigurace za tímto vzácným plynem (co je v prvku navíc oproti tomuto vzácnému plynu)
(vzácné plyny jsou ty, které jsou v periodické tabulce v posledním sloupečku – ve sloupečku VIII. A)
O: [He] 2s2 2p4